小胶质细胞的长期激活导致促炎介质的过度释放,这对大脑健康有害。因此,有显著的努力,以确定介导小胶质细胞激活的途径。最近的研究表明,脂肪酸结合蛋白4 (FABP4)是一种脂质结合蛋白,在巨噬细胞介导的炎症中起关键作用。鉴于我们之前已经在小胶质细胞中发现了FABP4,本研究的目的是评估FABP4活性是否有助于永生化小鼠小胶质细胞(BV-2细胞)的炎症、代谢和免疫功能(即免疫代谢),使用促炎刺激脂多糖(LPS)诱导一般小胶质细胞激活。暴露于LPS后,小胶质细胞FABP4表达显著增加,这一结果与小胶质细胞增殖率显著增加有关。lps刺激的BV-2小胶质细胞显示活性氧(ROS)和肿瘤坏死因子-α (TNF-α)的产生显著增加,c-Jun n -末端激酶(JNK)的磷酸化,toll样受体4 (TLR4)的表达增加,解偶联蛋白2 (UCP2)的表达减少,所有这些在BMS309403基因沉默和化学抑制FABP4后被逆转。3h -油酸的氧化速率和3h -2-脱氧-d -葡萄糖的小胶质细胞摄取通过LPS激活进行调节,这一过程通过FABP4的遗传和化学抑制得以恢复。这是首次报道FABP4在介导LPS对小胶质细胞免疫代谢的有害作用中的关键作用,表明FABP4可能作为一种新的治疗靶点来缓解小胶质细胞介导的神经炎症,这是多种神经退行性疾病中常见的一个因素。
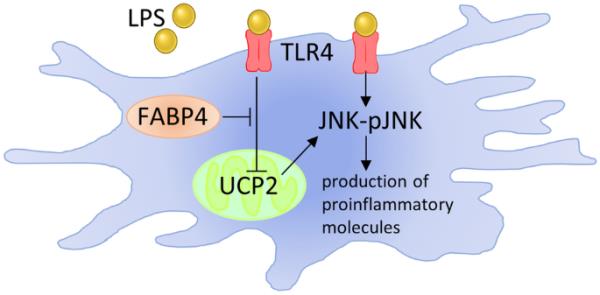
神经炎症被定义为中枢神经系统(CNS)的炎症反应,慢性神经炎症通常与几种神经退行性疾病的病理有关,如阿尔茨海默病(AD)、帕金森病(PD)和运动神经元病(MND) (Subhramanyam et al. 2019)。神经炎症的特征是活性氧(ROS)和促炎分子的过量产生和释放,主要是由中枢神经系统的常驻免疫细胞小胶质细胞产生和释放(Subhramanyam et al. 2019)。当受到刺激激活时,小胶质细胞可以采取一系列促炎或抗炎表型,以维持中枢神经系统的稳态。随着促炎小胶质细胞的长期激活,白细胞介素-1β (IL-1β)、肿瘤坏死因子-α (TNF-α)、ROS和一氧化氮(NO)的过度释放可导致神经元数量和功能的严重减少(Kaur等人,2014;Mallard et al. 2019)。考虑到小胶质细胞在各种神经退行性疾病中大量参与神经炎症,改善小胶质细胞介导的神经炎症的方法可以减少神经元损失,减缓神经退行性疾病的进展,如AD、PD和MND。
最近发现脂肪酸结合蛋白(FABP)亚型参与了巨噬细胞的激活过程(Hui et al. 2010)。FABP家族由11种不同的异构体组成,它们主要参与陪同脂肪酸(FAs)进入细胞及其周围。例如,FABP3在心脏和骨骼肌细胞中运输花生四烯酸(Hanhoff etal . 2002),而FABP5参与在脑内皮细胞中运输二十二碳六烯酸(Pan etal . 2015;Pan et al. 2016)。除了它们在细胞和FA运输中的作用外,一种特殊的异构体(FABP4)已被报道参与炎症过程。在促炎损伤的巨噬细胞中检测到FABP4表达升高,这与TNF-α和IL-12水平升高有关(Hotamisligil和Bernlohr 2015)。在FABP4缺陷小鼠或服用FABP4抑制剂的小鼠中,已证明对几种炎症性疾病具有耐药性。例如,基因缺失FABP4不仅可以保护小鼠免受动脉粥样硬化的侵害,还可以损害巨噬细胞诱导的炎症反应(Furuhashi等人,2007),这表明FABP4在外周巨噬细胞介导的炎症中起着关键作用。
据报道,FABP4也在小胶质细胞中表达(Duffy et al. 2017;Low等人,2021),并被证明在调节小胶质细胞暴露于饱和脂肪酸后的免疫表型中起重要作用。最近,Duffy等人证明,高棕榈酸饮食诱导的促炎反应在FABP4缺陷小鼠的下丘脑组织中减弱(Duffy et al. 2017)。他们进一步强调了一种新的fabp4解偶联蛋白2 (UCP2)轴。研究表明,UCP2可以介导小胶质细胞激活状态的能量过程,并且非特异性FABP抑制剂可以增加UCP2的表达,减少棕榈酸诱导的NO和ROS释放(Duffy et al. 2017)。因此,抑制小胶质细胞FABP4可能被认为对神经炎症有益,因为ROS的产生是驱动小胶质细胞介导的促炎反应的主要过程(Naik和Dixit 2011)。事实上,众所周知的促炎分子脂多糖(LPS)会降低UCP2的表达,导致小胶质细胞呈现促炎表型,促炎分子的释放增加(De Simone et al. 2015)。其他研究也报道LPS降低巨噬细胞和小胶质细胞中UCP2的表达,导致ROS生成增加和促炎细胞因子释放增加(Bai et al. 2005;Emre等人,2007;De Simone et al. 2015)。综上所述,这些发现表明FABP4-UCP2轴在LPS诱导的小胶质细胞介导的神经炎症中可能是必要的。
UCP2也参与细胞能量通路,众所周知,小胶质细胞在不同的激活状态下利用各种细胞能量通路(Ghosh et al. 2018;阿尔达纳2019)。在神经元和小鼠胚胎成纤维细胞中观察到,UCP2的表达参与氧化磷酸化(OXPHOS)和糖酵解途径之间的代谢转换(Emre和n
由于UCP2参与小胶质细胞代谢,而FABP4的存在可以影响UCP2的表达,因此操纵这些蛋白的水平有可能影响小胶质细胞的代谢和表型。因此,本研究的总体目的是研究FABP4的调节是否能够影响小胶质细胞代谢,从而影响暴露于LPS后激活状态下(即小胶质细胞免疫代谢)促炎分子的释放。本研究使用永生化小鼠小胶质细胞系(BV-2),首次研究了基因沉默FABP4对LPS激活后小胶质代谢、细胞因子释放和c- jun - n末端激酶(JNK)磷酸化的影响。随后,研究人员评估了BMS309403(一种有效的FABP4抑制剂)对BV-2细胞和原代培养小胶质细胞免疫代谢的影响,以确定FABP4是否可以作为减少神经炎症的可利用药理学靶点。
Dulbecco的磷酸盐缓冲盐水(PBS)、胎牛血清(FBS)、Pierce BCA蛋白测定试剂盒、Griess试剂试剂盒、巨噬细胞- sfm (1X)培养基、Pierce 20x TBS缓冲液、小鼠TNF-α未包被ELISA试剂盒和小鼠IL-6未包被ELISA试剂盒均购自Thermo Fisher Scientific (Grand Island, NY)。Dulbecco ' s Modified Eagle ' s Medium F-12 Ham (DMEM/F-12)、胰蛋白酶、台锥虫蓝、溴酚蓝、β-巯基乙醇、二甲基亚砜(DMSO)、牛血清白蛋白(BSA)、氢氧化钠(NaOH)、Tween-20、噻唑蓝溴化四唑(MTT)、青霉素/链霉素、罗氏cOmpleteTM蛋白酶抑制剂鸡尾酒片、PhosSTOP片、大肠杆菌O111:B4 LPS和2′,7′-二氯荧光素(DCF-DA)均购自Sigma-Aldrich (St Louis, MO)。MACS?CD11b+小鼠微珠、质谱柱和成年小鼠脑分离试剂盒购自Miltenyi Biotec (Bergisch Gladbach, Germany)。iTaq Universal Probes One-Step kit(包含2个探针RT-PCR反应混合物,iscript逆转录酶和无核酸酶水),0.2μm硝化纤维素膜,0.45μm免疫印迹低荧光PVDF膜,Precision Plus染色蛋白阶梯,Mini-PROTEAN TGX 4-15%和4-20%预制凝胶,特厚印迹纸购自BioRad (Hercules, CA)。QIAshredder色谱柱、RNeasy Mini Plus试剂盒、HiPerfect转染试剂、FlexiTube FABP4 siRNA (SI02695322)和AllStar Negative Control siRNA购自Qiagen (Hilden, Germany)。LI-COR Intercept?阻断缓冲液、LI-COR驴抗兔抗体(680 nm)和β-actin抗体一抗购自Millennium Science (Melbourne, Victoria, Australia)。抗fabp3抗体(ab45966)和抗fabp4抗体(ab66682)来自英国剑桥Abcam公司。抗fabp5抗体(39926)、抗ucp2抗体(D105V)、SAPK/JNK抗体(9252)和phospo -SAPK/JNK (Thr183/Tyr185)抗体(81E11)购自Cell signaling Technology公司(Danvers, MA)。抗tlr4(48-2300)抗体购自赛默飞世尔科学公司,BMS309403购自开曼化学公司(密歇根州安娜堡)。3h -油酸(3H-OA)购自American radiolabated Chemicals Inc (St. Louis, MO), 3h -2-脱氧-d -葡萄糖(3H-2-DG)和Ultima Gold液体闪烁混合物购自perkins - elmer (Boston, MA)。
BV-2细胞来源于Elisabetta Blasi博士(Blasi等人,1990年)的实验室,由Linda J. Van Eldik博士(肯塔基州列克星敦)慷慨提供。BV-2细胞在添加10% (v/v)牛血清和1% (v/v)青霉素/链霉素的DMEM/F-12培养基中培养。将细胞以20,000个细胞/cm2的速度接种到所需的培养皿中,将培养皿置于37°C, 5% CO2的培养箱中,待培养皿达到80%的合流度后用于实验。
所有需要使用小鼠分离小胶质细胞的实验都得到了莫纳什制药科学研究所动物伦理委员会(MIPS.27467)的批准,并按照澳大利亚国家卫生和医学研究委员会关于为科学目的护理和使用动物的准则进行。使用成人脑分离试剂盒(Miltenyi Biotec公司,Bergisch Gladbach,德国)和Miltenyi Biotec公司的gentleMACS?解离器,将麻醉后的C57BL/6雌性小鼠(6-8周龄)的大脑消化成单细胞悬液。然后使用MACS?MicroBeads和MS色谱柱(Miltenyi Biotec)对CD11b+细胞进行磁选。选择的细胞以50,000/cm2的速度接种到所需的板中,并在含有1% (v/v)青霉素/链霉素的巨噬细胞- sfm培养基中在37°C, 5% CO2培养箱中维持至融合。
播种后第二天,BV-2细胞用1μg/mL LPS处理24小时。为了沉默FABP siRNA,按照先前描述的方案,在播种后4小时转染BV-2细胞(Low et al. 2021)。简单地说,用FABP siRNA或AllStar Negative Control (siCont)转染BV-2细胞5分钟,然后用含fbs的培养基将siRNA复合物的浓度稀释到5 nM,用siRNA处理细胞孵育24小时,然后向细胞中加入LPS。BMS309403处理:BV-2细胞在播种24 h后,分别用LPS(1μg/mL)和BMS309403(50μM载药)或载药(0.1% (v/v) DMSO)共处理,孵育24 h后用于实验。评估的影响BMS309403 post-microglial激活,BMS309403(50μM汽车)或车辆(0.1% (v / v) DMSO)被添加到BV-2细胞已经处理有限合伙人(1μg / mL) 4 h。评估FABP4抑制在初级鼠小胶质细胞的影响,50μM BMS309403或车辆(0.1% (v / v) DMSO)添加2 h之前的有限合伙人(0.1μg / mL)和小胶质细胞被co-treated 24小时之前被用于实验。为了评估JNK的磷酸化活性和JNK的总水平,我们用LPS(1μg/mL)处理BV-2细胞30分钟,有或没有siRNA或BMS309403处理。
处理后,用WB定量测定BV-2细胞中FABPs、TLR4、UCP2和p-JNK/JNK的蛋白水平。处理后,BV-2细胞用冰冷的PBS洗涤,然后用Pierce IP裂解缓冲液添加罗氏cOmpleteTM迷你蛋白酶抑制剂裂解。在4°C下13400 xg离心10分钟后,使用Pierce BCA蛋白测定试剂盒测定蛋白计数。在BioRad 4-20%丙烯酰胺预制凝胶上,以5:1的比例用6倍Laemmli上样缓冲液将10 μg的蛋白质上样,使用BioRad Mini-PROTEAN Tetra细胞(Hercules, CA)在200伏下运行55分钟。电泳后,将凝胶与两张厚的印迹纸和一个0.2 μm的硝化纤维素膜一起,在含有20% (v/v)甲醇的转移缓冲液中平衡30分钟。然后使用BioRad半干transblot (Hercules, CA)将凝胶中的蛋白质以11伏电压转移到硝化纤维素膜上,持续42分钟。将膜在LI-COR Intercept?阻断缓冲液中孵育,然后在4°C下与特定小鼠FABP亚型(1:5000稀释)、TLR4(1:5000稀释)或UCP2(1:1000稀释)的一抗和LI-COR Intercept?阻断缓冲液中稀释的抗小鼠一抗β-肌动蛋白(1:10000稀释)孵育过夜。用驴抗兔二抗(1:3000稀释)室温孵育2小时。使用AmershamTM台风扫描仪(Marlborough, MA)对膜进行成像。使用Image J (Bethesda, MD)对WB波段进行密度分析,对感兴趣的蛋白相对于β-肌动蛋白(管家蛋白)进行定量。
在LPS处理前后12、24小时,通过血细胞计简单计数,观察3种不同培养皿制备的BV-2细胞的增殖率。为了确保BMS309403在BV-2细胞上的浓度对细胞活力没有显著影响,我们进行了MTT试验。处理后,BV-2细胞用PBS洗涤一次,每孔加入150μL 0.45 mg/mL MTT试剂(制备于不含fbs的DMEM/F-12培养基中)。37°C, 5% CO2孵育4小时。孵育后,去除MTT试剂,在所有孔中加入150μL DMSO,孵育30分钟。在Perkin-Elmer Enspire荧光板读取仪(Boston, MA)上,在540 nm处读取板。背景减除后,细胞存活率百分比表示为bms309403处理细胞的平均吸光度与载体处理细胞的平均吸光度之比。
按照之前的报道,测量了BV-2细胞中3H-OA的氧化速率(Ma et al. 2020)。简单地说,BV-2细胞在含有60μM OA和1 μCi 3H-OA的培养液中,37℃,5% CO2,孵育4 h。孵育后,取100 μL的上清液,与等体积的10% (v/v)三氯乙酸混合。在4°C下,13000 xg离心5分钟。取所得上清液的150 μL等分液,用冷甲醇:氯仿(2:1)和2m KCl:HCl处理,然后在3000 xg下离心5分钟。除去上(水)相(含有氧化的3H-OA, 3H2O)的等分液,与2ml闪烁液(Ultima Gold cocktail)充分混合,使用Perkin-Elmer 2800TR液体闪烁计数器(Boston, MA)测定放射性。生成的氧化3H-OA (3H2O)用BCA法归一化到总蛋白计数(μg),并以pmol/μg蛋白报告。
用空白培养基冲洗BV-2细胞和小鼠原代小胶质细胞,然后加入培养基中制备的3H-2-DG 1 μCi。15分钟后,去除3H-2-DG,用冰冷的PBS冲洗细胞三次,停止摄取。细胞经过冻融循环后,使用Pierce IP裂解缓冲液裂解,并与2ml闪烁液(Ultima Gold鸡尾酒)充分混合,测定放射性。用BCA法将细胞中3H-2-DG的量归一化为总蛋白数(μg),并以pmol/μg蛋白报告。
为了测量细胞内ROS,将BV-2细胞用温HBSS冲洗一次,然后与无fbs培养基中制备的40μM DCF-DA在37℃、5% CO2中孵育30 min。孵育后,用温HBSS冲洗孔一次,并将HBSS加入孔中,然后在Perkin-Elmer Enspire平板读取仪(Perkin-Elmer) (λex: 488 nm, λem: 535 nm)上读取。
为了测量NO的产生,将BV-2细胞放入96孔板中,按照制造商的方案(Molecular Probes, Eugene, OR)进行Griess实验。然后在Perkin-Elmer Enspire读板仪上在548 nm处读板。通过对培养基中制备的NaNO2进行连续稀释得到的标准曲线,反算出样品中的亚硝酸盐浓度。
按照制造商的方案进行elisa,以测量在存在和不存在LPS的情况下,FABP4敲除和抑制后,BV-2细胞和原代小鼠小胶质细胞释放的促炎细胞因子(TNF-α和IL-6)的量。处理后,将100 μL上清液与100 μL TNF-α或IL-6标准液一起加入预包被的ELISA板中。孵育2小时后井洗了洗缓冲区(0.05% (v / v) Tween-20 PBS)四次100μL之前检测抗体(特定感兴趣的细胞因子)添加到每个1 h。与洗井被洗了四次缓冲区100μL Streptavidin-HRP之前添加到每个30分钟。井又洗6次井与100μL孵化前三甲衬底15分钟。停止添加100μL后的解决方案,在Perkin-Elmer Enspire荧光板读卡器上分别在450 nm和570 nm处读取。从450nm处的吸光度值中减去570nm处的吸光度值以考虑背景。释放的细胞因子浓度按BCA测定的总蛋白计数(mg)归一化,并以pg/mg蛋白报告。
使用Graphpad Prism 8进行数据分析。所有数据均以mean±SEM表示,其中所有重复均为生物重复。在两组之间进行比较时,使用Student 's unpaired t检验。当两个以上的组进行比较时,进行方差分析(ANOVA),然后进行适当的事后检验,如图图例中所定义的。p<0.05为差异有统计学意义。
首先测定BV-2小胶质细胞中存在的三种FABP亚型FABP3、FABP4和FABP5的蛋白表达,以评估其表达是否受到LPS的影响。在所研究的三种FABP亚型中,在1μg/mL LPS刺激下,只有FABP4的表达显著增加,而FABP3和FABP5保持不变(图1A-C)。
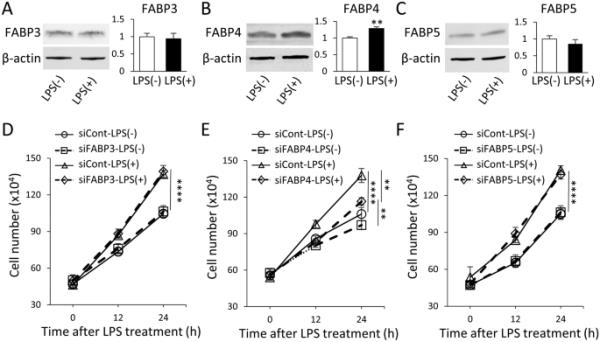
FABP4参与脂多糖诱导的小胶质细胞活化。A, B, C 1μg/mL LPS处理和不处理24 h后,(A) FABP3, (B) FABP4和(C) FABP5在β-肌动蛋白正常化的BV-2细胞中的表达。柱状图显示了用Image J软件分析的带密度。数据以均数±SEM表示(n=6-7),其中**p<0.01,采用学生非配对t检验进行评估。D, E, F分别用(D) FABP3 siRNA (siFABP3)、(E) FABP4 siRNA (siFABP4)、(F) FABP5 siRNA (siFABP5) (5 nM, 24 h)处理BV-2细胞,在1μg/mL LPS存在和不存在的情况下,细胞相对于siCont的增殖率。数据以均数±SEM表示(n=3),其中**p<0.01, ****p<0.0001,采用双向方差分析评估,随后进行事后Tukey检验
为了探索LPS对FABP表达的调节是否与小胶质细胞激活相关,我们在FABP沉默存在和不存在的情况下评估了BV-2细胞的增殖率,正如我们之前证明的那样,FABP4蛋白减少了82% (Low et al. 2021)。在不进行LPS处理的情况下,每次siFABP处理均不影响BV-2细胞的增殖率(图1D-F)。LPS处理显著提高了BV-2细胞的增殖率,但与siCont相比,只有siRNA处理FABP4对增殖率有抑制作用,尽管LPS处理和不处理sifabp4的细胞增殖率仍有显著差异(图1E)。这些结果表明,在评估的三种亚型中,只有FABP4在LPS诱导的小胶质细胞激活中起重要作用。
为了评估FABP4在小胶质细胞激活中的详细作用,我们重点研究了LPS-TLR4信号级联。在FABP4沉默后和lps处理后,检测BV-2细胞中常见促炎分子、NO、ROS、IL-6和TNF-α的水平。LPS显著增加了BV-2细胞中所有促炎分子的浓度(图2A)。与增殖率一致,FABP4的沉默显著降低了促炎分子的水平,尽管促炎分子的水平没有恢复到在载体处理的细胞中观察到的水平(图2A)。研究表明,包括JNK在内的丝裂原活化蛋白激酶(MAPK)信号在LPS刺激后被激活,导致促炎分子释放增加(Kagawa等,2015),我们评估了FABP4沉默是否能够破坏这一途径。FABP4的沉默减弱了lps诱导的pJNK的增加,尽管它没有恢复到在载体处理的细胞中观察到的水平(图2B)。我们进一步评估了TLR4的表达,发现FABP4沉默减弱了lps诱导的TLR4表达的增加(图2C),这表明小胶质细胞中LPS-TLR4信号级联的促炎作用依赖于FABP4。
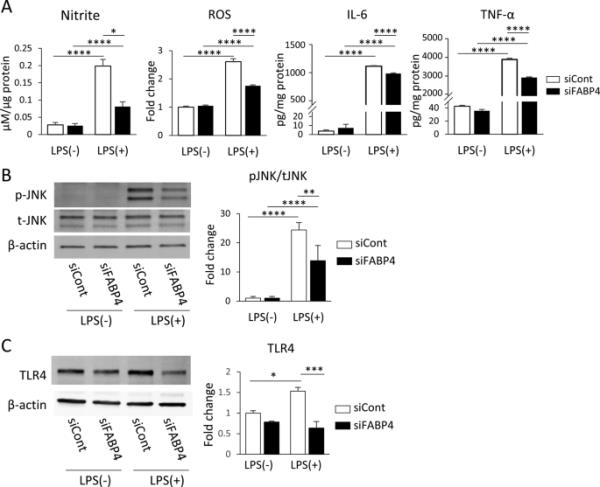
FABP4沉默降低了lps诱导的BV-2细胞的促炎反应。A在LPS(含或不含FABP4 siRNA)存在和不存在的情况下,BV-2细胞中亚硝酸盐、ROS、IL-6和TNF-α的水平/浓度(5 nM, 24 h)。数据以平均值±SEM (n=6)表示,其中*p<0.05和****p<0.0001,采用双向方差分析评估,随后进行事后Tukey检验。B添加或不添加FABP4 siRNA的BV-2细胞,在1 μg/mL LPS存在和不存在的情况下,Western blot检测pJNK和总tJNK。柱状图为使用Image J软件分析的pJNK/tJNK条带密度。数据以均数±SEM表示(n=4),其中**p<0.01, ****p<0.0001,采用双向方差分析评估,随后进行事后Tukey检验。C在1 μg/mL LPS存在和不存在的情况下,对BV-2细胞中添加或不添加FABP4 siRNA的TLR4和β-肌动蛋白进行Western blot检测。柱状图为用Image J软件分析归一化为β-肌动蛋白的TLR4条带密度。数据以均数±SEM (n=3)表示,其中*p<0.05和***p<0.001,采用双向方差分析进行评估,随后进行事后Tukey检验
考虑到FABP4基因敲低后小胶质细胞的促炎反应发生了变化,我们研究了一种有效的FABP4化学抑制剂BMS309403对FABP4的抑制是否会影响小胶质细胞的反应。在BMS309403处理24小时后进行的MTT试验表明,2-50μM的BMS309403对细胞活力没有显著影响,而与对照相比,75μM和100μM的BMS309403导致细胞活力降低(图3A)。因此,后续研究采用50 μM浓度的BMS309403,处理时间为24 h。
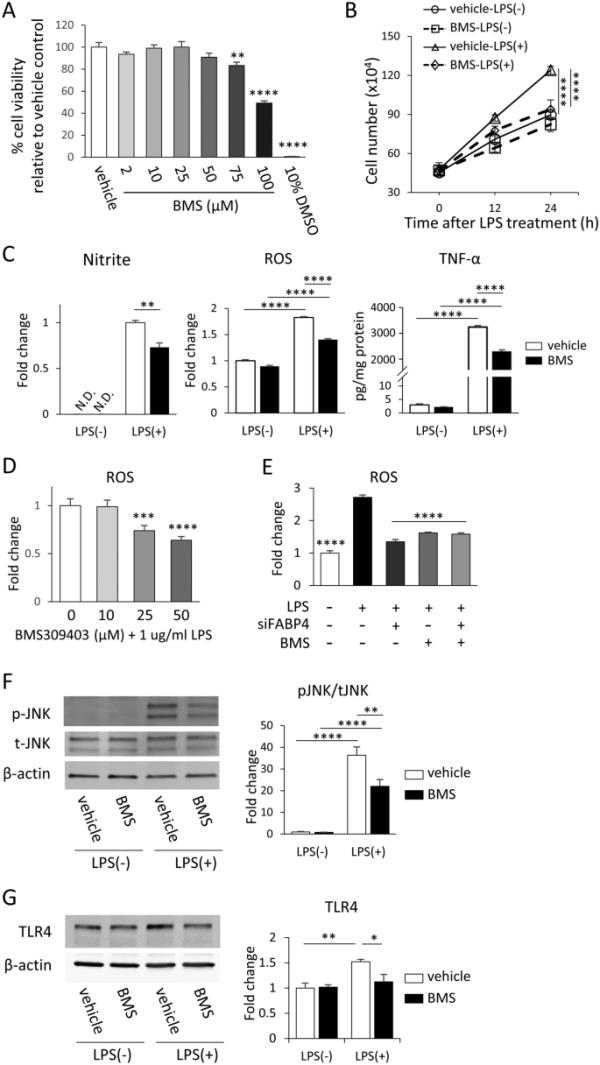
BMS309403降低lps诱导的BV-2细胞的促炎反应。增加浓度的BMS309403 (2-100 μM)或对照液暴露24 h后BV-2细胞活力。10% v/v DMSO作为阳性对照。**p<0.01, ****p<0.0001,采用单因素方差分析和事后邓尼特检验进行评估。1 μg/mL LPS处理后12、24 h B - BV-2细胞增殖率。LPS处理前,用载药或50 μM BMS309403处理细胞。数据以均数±SEM表示(n=3),其中****p<0.0001,采用双向方差分析和事后Tukey检验进行评估。C BV-2细胞中亚硝酸盐、ROS和TNF-α的水平/浓度。在LPS处理之前,分别用50 μM BMS309403或不加50 μM BMS309403处理细胞。数据以mean±SEM (n=6)表示,其中**p<0.01, ****p<0.0001,采用双向方差分析和事后Tukey检验进行评估。10-50μM BMS309403和1μg/mL LPS作用24小时后BV-2细胞的D ROS生成。***p<0.001, ****p<0.0001,采用单因素方差分析评估,随后采用事后邓尼特检验。BV-2细胞中E - ROS的产生。在LPS处理之前,用5 nM FABP4 siRNA、50 μM BMS309403或两者的组合处理细胞。与lps治疗组相比,****p<0.0001,采用单因素方差分析和事后Tukey检验进行评估。以上数据均用mean±SEM (n=6)表示。F在1 μg/mL LPS存在和不存在的情况下,BMS309403处理后BV-2细胞中pJNK和tJNK的Western blot检测。柱状图显示了用Image J软件对pJNK归一化后的条带密度进行分析。数据以均数±SEM (n=4)表示,其中**p<0.01, ****p<0.0001,采用双向方差分析和事后Tukey检验进行评估。G Western blot检测BMS309403处理BV-2细胞后,在1 μg/mL LPS存在和不存在的情况下,TLR4和β-肌动蛋白的条带密度。柱状图为用Image J软件分析归一化为β-肌动蛋白的TLR4条带密度。数据以均数±SEM (n=3)表示,其中*p<0.05和**p<0.01,采用双向方差分析和事后Tukey检验进行评估
为了确定BMS309403对lps介导的小胶质细胞活性的影响,我们进行了增殖实验。LPS处理后,BMS309403处理的BV-2细胞的增殖率明显低于载体处理的细胞(图3B)。同样,BMS309403以浓度依赖的方式减弱了脂多糖介导的BV-2细胞中亚硝酸盐、ROS和TNF-α分泌的增加(图3C),因为脂多糖与25μM和50μM BMS309403共处理,相对于仅处理脂多糖组,ROS的产生分别显著减少0.26倍和0.36倍(图3D)。为了确保BMS309403仅作用于FABP4产生这些抗炎作用,而不作用于其他靶点,我们在存在和不存在FABP4 siRNA的BV-2细胞中评估了BMS309403的作用。相对于存在FABP4的细胞,BMS309403不能进一步降低FABP4 siRNA处理细胞中的ROS水平(图3E),这表明BMS309403对ROS的影响确实是由于FABP4的抑制。此外,我们评估了BMS309403对TLR4- lps信号传导的影响,发现BMS309403处理后,lps介导的JNK激活和TLR4表达的增加被减弱(图3F, G)。
为了研究FABP4如何调节lps诱导的促炎级联反应,我们评估了FABP4参与lps处理的BV-2细胞中UCP2表达的调节。当LPS刺激时,BV-2细胞中的UCP2蛋白表达显著降低,然而当BV-2细胞中的FABP4基因沉默时,LPS对UCP2表达的影响被消除,UCP2表达恢复到sicont处理细胞中观察到的水平(图4A)。由于UCP2参与了OXPHOS和糖酵解途径之间的代谢转换,我们随后研究了基因沉默FABP4对小胶质细胞代谢的影响。LPS处理后,BV-2细胞中的3H-OA氧化(反映了OXPHOS途径)显着减少(图4B),而3H-2-DG摄取(反映了细胞中葡萄糖的使用)显着增加(图4C),这与炎症导致葡萄糖利用增加的概念一致。然而,当FABP4沉默时,LPS对3H-OA氧化和3H-2-DG摄取水平的影响被逆转(图4B, C), BMS309403处理也观察到这一结果(图4D, E),表明FABP4依赖的UCP2功能调节BV-2细胞的能量代谢。此外,BMS309403处理LPS处理的小鼠培养的原代小胶质细胞使3H-2-DG摄取恢复到缺乏LPS时的水平(图4F),这种对FABP4的化学抑制也抑制了LPS介导的小鼠原代小胶质细胞中TNF-α产生的增加(图4G)。
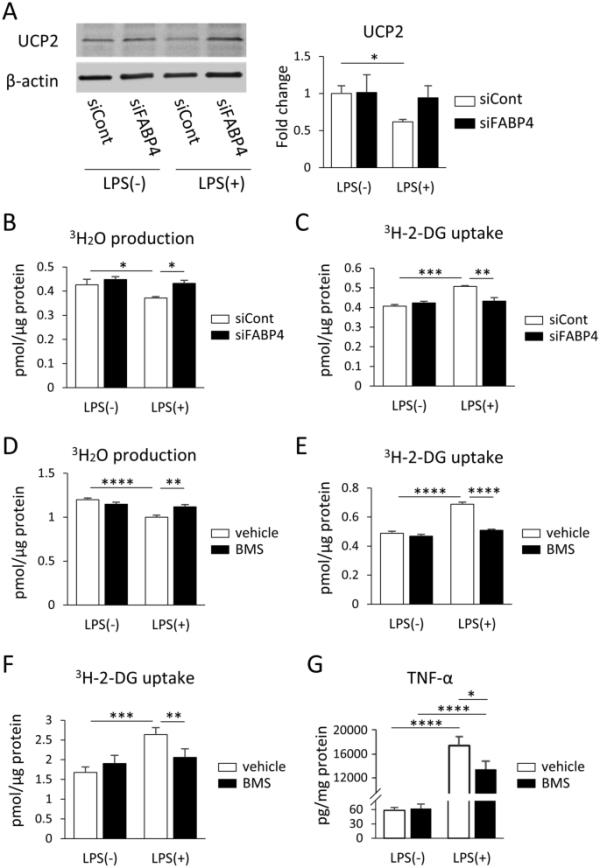
遗传和化学抑制FABP4可降低BV-2细胞和小鼠原代小胶质细胞中lps介导和UCP2依赖的代谢变化。在有或没有FABP4 siRNA的情况下,在1 μg/mL LPS存在和不存在的情况下,对BV-2细胞进行UCP2和β-actin的Western blot (5 nM, 24 h), 30 min。柱状图显示了用Image J软件分析UCP2/β-actin的能带密度。数据以均数±SEM (n=3)表示,其中*p<0.05,采用双向方差分析和事后Tukey检验进行评估。B, C在LPS处理后BV-2细胞中3H-OA氧化(B)和3H-2-DG摄取(C),有和没有FABP4基因沉默。数据用mean±SEM表示(n=4-6),其中*p<0.05, **p<0.01, ***p<0.001,采用双向方差分析进行评估,随后进行事后Tukey检验。D, E, LPS处理后BV-2细胞3H-OA氧化(D)和3H-2-DG摄取(E),加和不加50μM BMS309403处理。数据用mean±SEM表示(n=4-6),其中**p<0.01, ****p<0.0001,采用双向方差分析和事后Tukey检验进行评估。1μg/mL LPS处理24小时,加或不加50μM BMS309403处理后小鼠原代小胶质细胞f3h - oa氧化。数据以均数±SEM表示(n=8),其中**p<0.01, ***p<0.001,采用双向方差分析和事后Tukey检验进行评估。G在50μM BMS309403存在和不存在的情况下,用或不加0.1μG /mL LPS处理小鼠原代小胶质细胞24 h时TNF-α的浓度。数据以均数±SEM表示(n=8),其中*p<0.05, ****p<0.0001,采用双向方差分析评估,随后进行事后Tukey检验
为了确定BMS309403是否可以减少LPS激活后的炎症反应,除了之前的数据显示BMS309403在与LPS同时暴露时可以减少LPS介导的效应外,我们在LPS激活后4小时用BMS309403处理BV-2细胞。当BMS309403在这个阶段被引入时,它仍然能够减少lps介导的ROS和TNF-α产生的增加(图5),这表明BMS309403即使在小胶质细胞激活后也可以减少促炎表型。
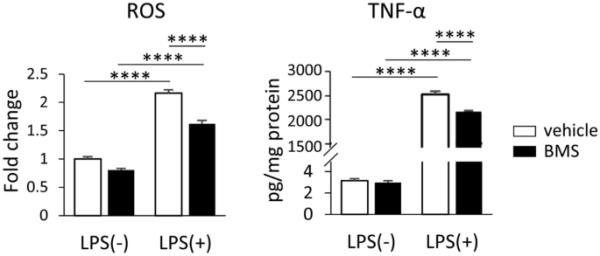
BMS309403减少小胶质细胞激活后ROS和TNF-α的产生
LPS(1μg/mL)预处理4 h后,BV-2细胞暴露于50 μM BMS309403中20 h, ROS和TNF-α水平/浓度。数据以均数±SEM表示(n=6),其中****p<0.0001,采用双向方差分析和事后Tukey检验进行评估。
发表评论
暂时没有评论,来抢沙发吧~